衛生福利部函釋中央研究院臺灣人體生物資料庫倫理委員會(EGC)和研究倫理委員會(IRB)的權責區分
一、中央研究院生物醫學科學研究所函轉 衛生福利部105年10月11日衛部醫字第1051667054號函,內容說明如下:
1.研究倫理委員會(IRB)依據「人體研究法」規定成立,對該機構研究計畫進行審查並對其審查通過之研究計畫負管理查核之責。
2.人體生物資料庫及其倫理委員會(EGC)依據「人體生物資料庫管理條例」規範設立,EGC依法對該生物資料庫在人體組織與資料資訊之收集、管理和運用等有關事項負有審查及監督之權責。
3.研究者如欲申請人體生物資料庫之使用,仍應依「人體研究法」第5條規定,擬定研究計畫經該機構研究倫理委員會(IRB)審查通過後始得向人體生物資料庫提出申請。
4.人體生物資料庫倫理委員會(EGC)及研究倫理委員會(IRB)兩委員會成立之法規依據、目的、人員組成及角色均不同,應依權責妥善分工並遵守相關規定辦理。
二、衛生福利部復於105年12月14日召開會議,其決議如下所述:
1.請臺灣人體生物資料庫進行IRB計劃變更。
2.按「人體生物資料庫管理條例」及「人體研究法」之規定,彼此之權責示意圖如下:
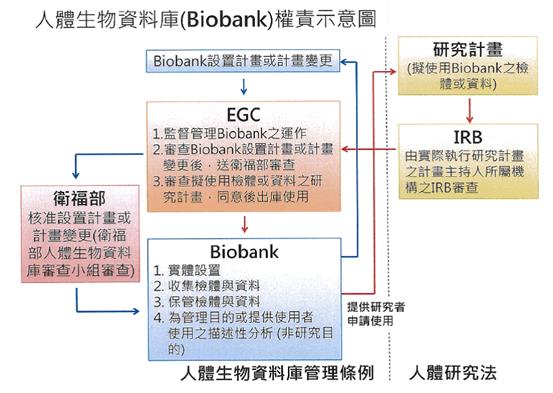
3.依衛生福利部所訂定之示意圖,人體組織與資料資訊之收集及管理受EGC之管轄與監督,不需經過IRB的審查,遵循「人體生物資料庫管理條例」之規定,而擬使用Biobank資源的研究計劃須先通過IRB的審查,遵循「人體研究法」之規定。
4.各家醫院的人體生物資料庫與臺灣人體生物資料庫的合作收案,應依「人體生物資料庫管理條例」有關「移轉」之規定辦理,以「一次移轉」的模式進行檢體與資訊資料的轉移。
